

RHEUMATOLOGY GROUP
難病とされる膠原病をあつかう臨床教室として、私たちに与えられた使命は「新規治療法の開発」につきますが、新規治療を生み出すためには膠原病の病態を正確に把握しなければならず、「膠原病の病態解明」が重要な目標となります。私たちはこの目標をめざして日々研究を続けております。
抗リン脂質抗体症候群(APS)は凝固・線溶タンパクに対する自己抗体により、血栓症または妊娠合併症を生じる疾患です。抗リン脂質抗体(aPL)の抗原はリン脂質ではなく、リン脂質に結合する凝固・線溶タンパクであり、代表的なものとしてカルジオリピン(CL)に結合する2グリコプロテインI(2GPI)、ホスファチジルセリン(PS)に結合するプロトロンビン(PT)が知られています。しかしながら、依然として治療は抗血栓療法のみしかなく、病態に基づいた根本的治療の確立が求められており、私たちは臨床研究・基礎研究を行なっています。
PSに結合するPTを認識するaPLをホスファチジルセリン依存性抗プロトロンビン抗体(aPS/PT)と呼びます。私たちはaPS/PTを測定するELISAを確立し、aPS/PTがAPS患者の大部分に認められ、臨床症状と強く相関していることを発見しました。 aPLはリン脂質と結合した抗原タンパクが構造変化を起こし表出するエピトープを認識します。aPLが凝固・線溶タンパクの機能に作用するのではなく、aPLが凝固・線溶タンパクを介して向血栓細胞である単球、血管内皮細胞、血小板を活性化させる機序が血栓症の病態であると考えられています。
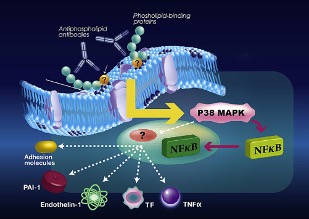
図1.抗リン脂質抗体による向血栓細胞活性化の機序
【主要論文】
1. Oku, K Atsumi,T Bohgaki,M Amengual,O Kataoka,H Horita,T Yasuda,S Koike,T. Complement activation in patients with primary antiphospholipid syndrome. Ann Rheum Dis. 68(6), 1030-5, 2009.
2. Otomo K, Atsumi T, Amengual O, Fujieda Y, Kato M, Oku K, Horita T, Yasuda S, Koike T. The efficacy of antiphospholipid score for the diagnosis of antiphospholipid syndrome and its predictive value for thrombotic events. Arthritis Rheum. 64(2): 504-512, 2012
3. Ohnishi N, Fujieda Y, Hisada R, Nakamura H, Kato M, Oku K, Bohgaki T, Amengual O, Yasuda S, Atsumi T. Efficacy of dual antiplatelet therapy for preventing recurrence of arterial thrombosis in patients with antiphospholipid syndrome. Rheumatology (Oxford). 58(6): 969-974, 2019.
4. Hisada R, Kato M, Sugawara E, Kanda M, Fujieda Y, Oku K, Bohgaki T, Amengual O, Horita T, Yasuda S, Atsumi T. Circulating plasmablasts contribute to antiphospholipid antibody production, associated with type I interferon upregulation. J Thromb Haemost. 17(7): 1134-1143, 2019.
5. Ogata Y, Fujieda Y, Sugawara M, et al. Morbidity and mortality in antiphospholipid syndrome based on cluster analysis: a 10-year longitudinal cohort study. Rheumatology (Oxford). 2020 Sep 18:keaa542.
全身性エリテマトーデス(Systemic lupus erythematosus : SLE)は、20歳から40歳代の女性に好発する代表的自己免疫疾患のひとつです。発熱や皮疹、関節痛など多彩な臨床症状を呈し、全身の臓器を障害します。推定患者数は、日本では5~6万人と比較的稀な疾患ですが、当科では300名を超えるSLE患者を継続的に診療しており、日本でも屈指の規模を誇ります。蓄積した豊富なデータベースを用いてSLEの重要臓器障害である、ループス腎炎や精神中枢ループスの疫学研究を行っています。 これまでに我々はSLE患者のT細胞において、Rasを活性化するguanine nucleotide exchange factorのひとつであるRasGRP1のスプライシング異常がおきていること、SLEの病態に関与していることを示してきました。近年は細胞内代謝に注目して研究をすすめています。細胞内代謝には解糖系、glutaminolysis、脂肪酸代謝などがあり、様々な細胞の分化、増殖に関わっています。ハーバード大学のTsokos Labと共同でCD4陽性T細胞の分化に解糖系、glutaminolysisが必須であること、またこれらがSLEモデルマウスの治療ターゲットとなることを示しました(図1)。近年はT細胞のみならず様々な細胞の細胞内代謝に注目して研究を進めています。

図1.SLE患者のT細胞における細胞内代謝の異常(Kono Michihito, et al. Curr Opin Rheumatol. 32(2):192-199, 2020より改変)
【主要論文】
1. Abe N, Tarumi M, Fujieda Y, Takahashi N, Karino K, Uchida M, Kono M, Tanaka Y, Hasebe R, Kato M, Amengual O, Arinuma Y, Oku K, Sato W, Tha KK, Yamasaki M, Watanabe M, Atsumi T, Murakami M. Pathogenic neuropsychiatric effect of stress-induced microglial interleukin 12/23 axis in systemic lupus erythematosus.Ann Rheum Dis, in press.
2. Karino K, Kono M, Takeyama S, Kudo Y, Kanda M, Abe N, Aso K, Fujieda Y, Kato M, Oku K, Amengual O, Atsumi T. IKBKE contributes to neuropsychiatric manifestations in lupus-prone mice through microglial activation Arthritis Rheumatol. in press.
3. Aso K, Kono M, Abe N, Fujieda Y, Kato M, Atsumi T. Anti-ganglionic nicotinic acetylcholine receptor α3 subunit antibody as a potential biomarker associated with lupus enteritis. Modern Rheumatology, in press.
4. Aso K, Kono M, Kono M, Watanabe T, Shimizu Y, Ogata Y, Fujieda Y, Kato K, Oku K, Amengual O, Yasuda S and Atsumi T. Low complement component 4 as a risk factor for severe neuropsychiatric flare in patients in systemic lupus erythematosus. Lupus. 29(10):1238-1247. 2020
5. Kono Michihiro, Kurita T, Yasuda S, et al. Decreased expression of Serine/arginine-rich splicing factor 1 in T cells from patients with active systemic lupus erythematosus contributes to reduced expression of RasGRP1 in correlation with DNA methyltransferase 1. Arthritis Rheum. 70(12):2046-2056, 2018.
私たちは滑膜線維芽細胞(図1)に着目して関節リウマチの病態の解明を目指した研究を行っています。滑膜線維芽細胞は関節リウマチの病態で中心的な役割を担う細胞です。TNF-αなどのサイトカインの存在下で強く増殖し、IL-6やMMP(マトリックスメタロプロテイナーゼ)といった炎症、関節破壊に寄与するタンパク質を多く産生します。また、RANKLを発現することで破骨細胞の分化を誘導します(図2)。さらに、最近の私たちの研究により、滑膜線維芽細胞が抗シトルリン化タンパク質抗体の産生、つまり自己免疫にも寄与していることが示唆されています。
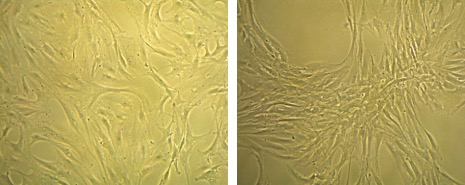
図1.滑膜線維芽細胞のin vitro培養。
左は通常の培養液で、右はTNF-αを加えた培養液で培養したもの。TNF-αの存在下で培養した滑膜線維芽細胞の強い増殖能が観察できる(未発表データ)。
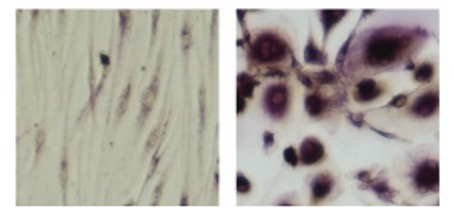
図2.滑膜線維芽細胞と単球の共培養および酒石酸耐性酸性ホスファターゼ染色。
左は通常の滑膜線維芽細胞、右はRANKL発現上昇させた滑膜線維芽細胞を用いた。RANKL発現上昇させた滑膜線維芽細胞と共培養した単球はより多く破骨細胞(酒石酸耐性酸性ホスファターゼ陽性の多核巨細胞)へと分化している(Lee WS, et al. Arthritis Rheumatol. 2020より一部改変)。
【主要論文】
1. Lee WS, Kato M, Sugawara E, et al. Protective role of optineurin against joint destruction in rheumatoid arthritis synovial fibroblasts. Arthritis Rheumatol. 72(9):1493-1504, 2020.
2. Sugawara E, Kato M, Kudo Y, et al. Autophagy promotes citrullination of VIM (vimentin) and its interaction with major histocompatibility complex class II in synovial fibroblasts. Autophagy. 16(5):946-955, 2020.
3. Nakamura H, Shimamura S, Yasuda S, et al. Ectopic RASGRP2 (CalDAG-GEFI) expression in rheumatoid synovium contributes to the development of destructive arthritis. Ann Rheum Dis. 77(12): 1765-1772, 2018.
4. Kono Michihito, Yasuda S, Stevens RL, et al. RasGRP4 is aberrantly expressed in the fibroblast-like synoviocytes of patients with rheumatoid arthritis and controls their proliferation. Arthritis Rheumatol. 67(2): 396-407, 2015.
強皮症(SSc; systemic sclerosis)は手指潰瘍、逆流性食道炎、間質性肺疾患、腎クリーゼなど様々な臓器合併症を伴いますが、中でもとりわけ予後にかかわるのが肺動脈性肺高血圧症(PAH; pulmonary arterial hypertension)です。私たちはSSc-PAH患者さんの予後改善を目指し、臨床、基礎両面から研究を行っています。肺高血圧症は表1に示すように5つのグループに分類されていますが、SSc-PAHでは肺血管の異常のみならず左心性疾患や拘束性肺疾患がしばしば合併し、第1+2+3群ともいうべき複雑なメカニズムにより肺血圧が上昇します。私たちは心臓MRI、肺拡散能、胸部CTの定量的解析といった様々なモダリティを統合し、この複雑なメカニズムの解明に挑んでいます。同時に、SSc-PAHに特異的な新しい治療法を開発すべく、iPS細胞を用いた基礎研究を行っています(図1)。
表1.肺高血圧症の臨床分類(Simonneau G, et al. Eur Respir J. 2019より改変)


図1.左:SSc-PAH患者の末梢血単核球から作成したiPS細胞。右:そのiPS細胞から分化誘導させた血管内皮細胞(未発表データ)。
【主要論文】
1. Moriya H, Kato M, Hisada R, et al. The chest CT signs for pulmonary veno-occlusive disease correlate with pulmonary hemodynamics in systemic sclerosis. Rheumatology (Oxford). in press.
2. Ninagawa K, Kato M, Tsuneta S, et al. Beneficial effects of nintedanib on cardiomyopathy in patients with systemic sclerosis: a pilot study. Rheumatology (Oxford). 62(7):2550-2555, 2023.
3. Ninagawa K, Kato M, Ohira H, et al. The assessment of left heart disease in patients with systemic sclerosis and pulmonary hypertension. Clin Exp Rheumatol. 131(4):103-110, 2021.
4. Abe N, Kato M, Kono Michihito, et al. Right ventricular dimension index by cardiac magnetic resonance for prognostication in connective tissue diseases and pulmonary hypertension. Rheumatology (Oxford). 59(3):622-633, 2020.
5. Ninagawa K, Kato M, Nakamura H, et al. Reduced diffusing capacity for carbon monoxide predicts borderline pulmonary arterial pressure in patients with systemic sclerosis. Rheumatol Int. 39(11):1883-1887, 2019.
診療活動と密接に関連した、非常に多くの単施設もしくは多施設の臨床研究が行われています。また1つの症例を深く追求し、ハイインパクトのjournalへ投稿しています。これら以外にも、新規生物学的製剤の治験への参加や厚生労働省班研究の多くにも参加しております。
【臨床論文】
1. Abe N, Kono M, Kono M, Katsuyama T, Ohmura K, Sato T, Karino K, Fujieda Y, Kato M, Hasebe R, Murakami M, and Atsumi T. Cytokine and chemokine multiplex analysis-based exploration for potential treatment and prognostic prediction in large-vessel vasculitis: a preliminary observational study. Frontiers in Immunology in press.
2. Abe N, Fujieda Y, Tha KK, et al. Aberrant functional connectivity between anterior cingulate cortex and left insula in association with therapeutic response to biologics in inflammatory arthritis. Seminars in Arthritis and Rheumatism. 2022 Aug;55:151994.
3. Abe N, Kono M, Kono M, et al. Glycogen synthase kinase 3β/CCR6-positive bone marrow cells, correlating disease activity in multicentric Castleman disease-TAFRO. British Journal of Haematology. 2022 Mar;196(5):1194-1204.
4. Karino K, Kono M, Kono M, et al. Myofascia-dominant involvement on whole-body MRI as a risk factor for rapidly progressive interstitial lung disease in dermatomyositis. Rheumatology (Oxford). 2020 Jul 1;59(7):1734-1742.
5. Atsumi T, Tanaka Y, Yamamoto K, et al. Clinical benefit of 1-year certolizumab pegol (CZP) add-on therapy to methotrexate treatment in patients with early rheumatoid arthritis was observed following CZP discontinuation: 2-year results of the C-OPERA study, a phase III randomised trial. Ann Rheum Dis. 2017 Aug;76(8):1348-1356.
6. Kurita T, Yasuda Y, Oba K, et al. The efficacy of tacrolimus in patients with interstitial lung diseases complicated with polymyositis or dermatomyositis. Rheumatology (Oxford). 2015 Jan;54(1):39-44.
【症例報告】
1. Nakamura H, et al. Remission of Nephrotic Syndrome After Therapy for Chronic Hepatitis C Virus Infection in a Patient With Systemic Lupus Erythematosus. Ann Intern Med. 2018 Sep 4;169(5):352-353.
2. Abe N, et al. Disseminated Cryptococcosis with Bronchiolitis and Cellulitis. Am J Respir Crit Care Med. 2019 Jan 15;199(2):235-236.
3. Abe N, et al. Disseminated subcutaneous nodules and destructive polyarthritis. BMJ. 2019 Apr 17;365:l1344.
4. Abe N, et al. Chronic active Epstein-Barr virus infection. Blood . 2020 Oct 29;136(18):2090.
日本内科学会
日本リウマチ学会
日本血栓止血学会
日本免疫学会
日本臨床免疫学会
日本炎症再生学会
日本骨粗鬆症学会
日本アレルギー学会
日本検査血液学会
日本老年医学会
![]()
| 氏名 | 役職 | 出身大学 | 卒業年度 |
|---|---|---|---|
| 渥美 達也 | 教授 | 北海道大学 | 1988年(昭和63年) |
| 小谷 俊雄 | 客員臨床講師 |
旭川医科大学 |
2004年(平成16年) |
| 藤枝 雄一郎 | 講師 |
日本大学 |
2004年(平成16年) |
| 河野 通仁 | 講師 | 北海道大学 | 2006年(平成18年) |
| 久田 諒 | 助教 | 北海道大学 | 2010年(平成22年) |
| 竹山 脩平 | 大学院生 | 北海道大学 | 2014年(平成26年) |
| 守谷 悠 | 大学院生 | 札幌医科大学 | 2016年(平成28年) |
| 鎌田 和郎 | 大学院生 | 北海道大学 | 2017年(平成29年) |
| 沖 庸太郎 | 大学院生 | 東京医科大学 | 2017年(平成29年) |
| 宮本 健一 | 大学院生 | 北海道大学 | 2018年(平成30年) |
| 井上 雄太 | 大学院生 | 北海道大学 | 2018年(平成30年) |
| 工藤 友喜 | 大学院生 (博士 医科学) | 秋田大学 | 2018年(平成30年) |
| 比佐 真太郎 | 大学院生 | 長崎大学 | 2020年(令和2年) |
| 馬場 大介 | 大学院生 | 北海道大学 | 2020年(令和2年) |
| 宋 雨潔 | 大学院生(博士 医科学) | 南方医科大学 |
2023年(令和4年) |